南京大学朱少林课题组JACS:镍催化多组分偶联—烯烃的还原氢羰基化反应合成α-手性酮
发布时间: 2021-09-15 08:45:24 作者:大钴 来源: 转自网易网-化学加网 浏览次数:
导读
近日,南京大学朱少林教授课题组在J. Am. Chem. Soc.上发表论文,报道了一种镍催化多组分区域选择性和对映选择性偶联反应,涉及加氢甲酰化和羰基化的串联过程。同时,该策略能够对各种未活化的烯烃直接进行还原氢羰基化反应,从而生成含有α-立体中心的非对称二烷基酮,例如手性α-芳基酮和α-氨基酮。该策略使用手性双噁唑啉作为配体,硅烷作为还原剂,氯甲酸酯作为安全的CO源,外消旋仲苄基氯或受保护的α-氨基酸N-羟基邻苯二甲酰亚胺(NHP)酯作为烷基化试剂。此外,该策略还适用于复杂分子的后期功能化。文章链接DOI:10.1021/jacs.1c07851。

(图片来源:J. Am. Chem. Soc.)
羰基化合物及其衍生物是许多天然产物和药物中的重要结构骨架,同时也是合成复杂分子的重要中间体。过渡金属催化的羰基化反应,作为一种具有吸引力且高效的合成方法,已广泛用于学术界和工业界。然而,此类反应常存在使用贵金属催化剂(例如Pd、Rh、Ru或Ir)或使用过量有毒且易燃的CO作为羰基源,从而限制了反应的应用。近年来,镍作为廉价催化剂备受关注,尤其是涉及C(sp 3)部分的羰基化反应中。为了避免在过量CO存在下形成失活的镍/羰基配合物(如 Ni(CO)4 ),Gosmini和胡喜乐课题组通过将锌还原剂和钴或镍催化剂相结合,可实现氯甲酸乙酯原位生成CO,从而作为CO安全有效的替代源。 下载化学加APP,阅读更有效率。
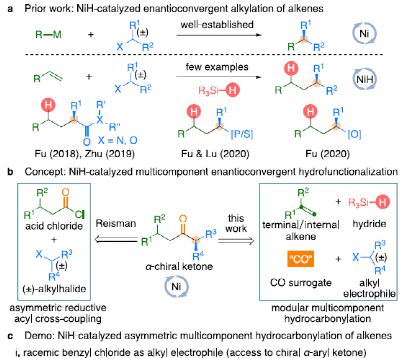
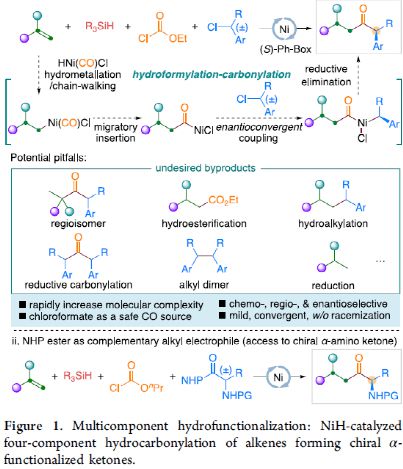
金属氢化物催化烯烃的加氢官能化是一种具有吸引力的策略,可避免有机金属试剂的合成。在过去几年中,通过镍氢化物催化烯烃与外消旋烷基亲电试剂的对映汇聚加氢烷基化反应,从而合成了一系列具有价值的官能团化C(sp 3)立体中心(Figure 1a )。相比之下,由于反应性和选择性难以同时控制,镍氢化物催化烯烃分子间的多组分加氢官能团化在很大程度上仍未得到发展( Figure 1b, right )。2013年,Reisman课题组首次报道了镍催化不对称还原交叉偶联反应,从而合成对映体富集的无环 α , α -二取代酮衍生物(Figure 1b, left )。朱少林课题组设想,是否可通过原位生成的氢化镍配合物参与连续的加氢甲酰化和羰基化反应,生成 α -手性酮(Figure 1c )。首先,原位形成的氢化镍羰基配合物[HNi(CO)LCl],将促进与烯烃的加氢金属化/链行走反应,生成位阻较少的伯烷基镍中间体。随后,CO迁移插入,然后与外消旋仲烷基亲电试剂,如苄基氯( Figure 1c, i )或受保护的 α -氨基酸NHP酯(Figure 1c, ii ),进行对映汇聚交叉偶联,从而生成非对称的含有 α -官能化立体中心的二烷基酮。
(图片来源: J. Am. Chem. Soc. )
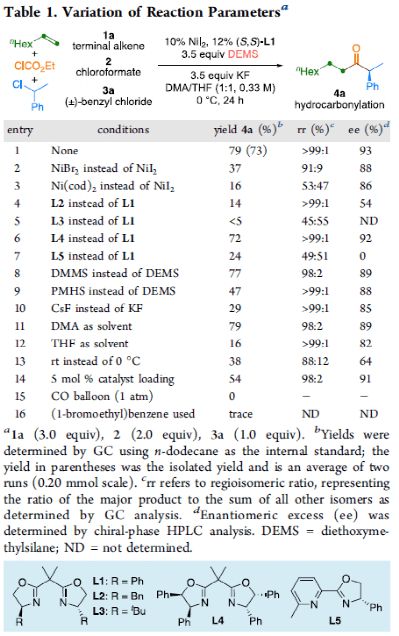
首先,作者以1-辛烯( 1a )、氯甲酸乙酯( 2 )与(1-氯乙基)-苯( 3a )作为模型底物,对还原性氢羰基化反应条件进行了筛选( Table 1 )。筛选结果表明,当使用NiI 2 作为预催化剂,DEMS作为还原剂,( S , S )-苯基双(噁唑啉)(Ph-Box)作为配体,KF作为碱,可获得73%收率的产物 4a ,ee为93%。
(图片来源: J. Am. Chem. Soc. )
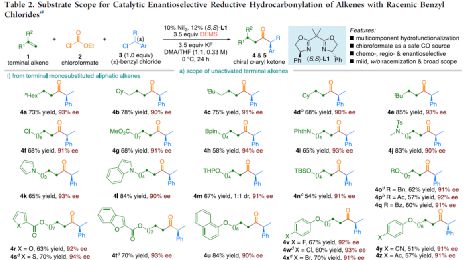
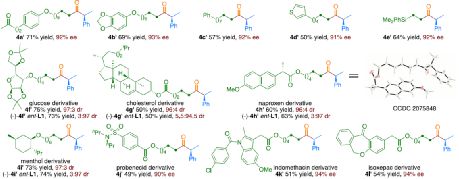
在获得上述最佳反应条件之后,作者对底物范围进行了扩展( Table 2 )。首先,未活化的单取代和1,1-二取代末端烯烃均可顺利反应,获得相应的 anti -Markovnikov 氢羰基化产物 4a - 4l' 和 4m' - 4p' ,收率为49-84%,ee为90-94%。值得注意的是,该反应具有良好的官能团耐受性,如酯基、卤素、酮基、杂环取代基等,均与体系兼容。同时,通过对天然产物和药物相关分子的后期功能化,如葡萄糖、胆固醇、萘普生、薄荷醇、丙磺舒、吲哚美辛、伊索克酸等衍生物,均可获得相应的手性 α -芳基酮衍生物 4f' - 4l' ,进一步证明了反应的实用性。此外,一系列外消旋苄基氯亲电试剂,在标准条件下,也可顺利反应,获得相应的产物 5b - 5l ,收率为56-88%,ee为88-94%。
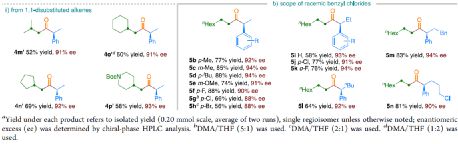
(图片来源: J. Am. Chem. Soc. )
为了进一步证明该策略的通用性,作者通过易得的( ±)- α -氨基酸合成 N -羟基邻苯二甲酰亚胺(NHP)酯(作为烷基化偶联底物),通过对反应条件的优化后,可获得一系列具有价值的对映体富集 α -氨基酮衍生物(Table 3 )。因此,作者又对底物范围进行了扩展,一系列未活化的末端烯烃和NHP酯,在优化的条件下,均可顺利反应,获得相应的产物 9a - 9t 和 10b - 10t ,收率为38-82%,ee为85-95%。值得注意的是,该反应同样具有良好的官能团耐受性,如烷基卤、醚、芳基卤、杂环取代基等,均与体系兼容。下载化学加APP,阅读更有效率。

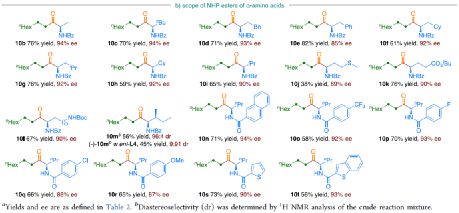
(图片来源: J. Am. Chem. Soc. )
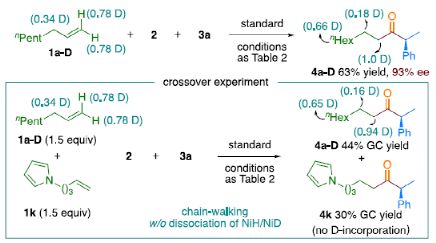
最后,作者对反应的机理进行了研究( Scheme 1 )。首先,当使用非对称的1,1-二取代烯烃( 1q' )为底物,在标准条件下反应时,催化剂不能对烯烃取代基有效地区分,仅获得dr为1.2:1的产物 4q' ( Scheme 1a )。当使用未活化的内烯烃(如2-辛烯的 E / Z 混合物)为底物,在标准条件下反应时,观察到加氢金属化、链行走、羰基化的过程( Scheme 1b )。其次, 4a 的克级实验,同样取得预期的结果( Scheme 1c )。同时,当使用等摩尔的 1a 和 1m' 进行了竞争实验时,分别获得相应的偶联产物 4a 和 4m' ,比例为2:1,从而表明空间位阻较小的单取代末端烯烃更具反应性( Scheme 1d )。此外,以氘代烯烃 1a-D 为底物,在标准条件下进行了同位素标记实验中发现,即使是末端烯烃也会发生链行走的过程( Scheme 1e, top )。同时,由于未观察到分子间氢氘置乱交叉产物,从而表明链行走的过程中NiH不会从烯烃中解离( Scheme 1e, bottom )。
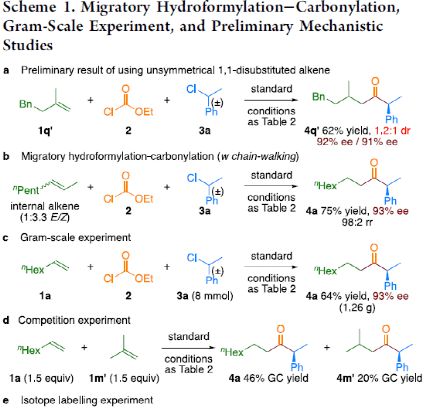
(图片来源: J. Am. Chem. Soc. )
总结:南京大学朱少林教授课题组报道了一种镍催化分子间的多组分还原加氢甲酰化-羰基化反应,涉及加氢金属化、链行走、区域选择性CO插入、对映汇聚烷基化等串联过程。同时,该反应具有反应条件温和、底物范围广泛、官能团耐受性高等特点。此外,通过该策略可合成一系列具有价值对映体富集的 α -官能化酮衍生物,如手性 α -芳基酮和 α -氨基酮。

